Vacunas VRS: aclarando los datos de los ensayos clínicos.
Ayer, VRBPAC–el comité científico externo de la FDA–se reunió para hablar de los últimos ensayos clínicos en relación con las vacunas de VRS. Se trata de un asunto muy importante porque podría ser la primera vacuna de VRS que llega al mercado, algo que hemos estado esperando durante décadas. (Literalmente desde los años 60, cuando las primeras vacunas terminaron en un gran fracaso en los niños).
El objetivo de esta reunión era presentar y debatir la seguridad y la eficacia de estas vacunas. Algunos de los datos de seguridad son ajustados, así que guarde este artículo a mano para cuando lo necesite. Olemos cómo se está cociendo la desinformación.
Aquí tienen los apuntes de la reunión.
Opciones de vacunas
Tanto Pfizer como GlaxoSmithKline (GSK) están solicitando la licencia. Sus vacunas de VRS son para adultos mayores de 60 años. Las dos son vacunas de una sola dosis para ponerse antes del invierno.
Las vacunas difieren ligeramente en cuanto a su diseño:
GSK (nombre de la vacuna: Arexvy) utiliza un adyuvante (llamado AS01E)–un ingrediente que ayuda a la vacuna a crear una respuesta inmune más sólida y que ha demostrado dar respuestas inmunes más largas.
Pfizer (nombre de la vacuna: Abrysvo) no tiene adyuvante. Todo el mundo ha tenido ya una infección por VRS en su vida, así que dando solo la proteína, se pueden activar las células de memoria de infecciones previas para que hagan todo el trabajo. Los adyuvantes generalmente dan más síntomas después de la vacunación, así que, a juicio de Pfizer, no merecían la pena. (Pfizer no encontró ningún beneficio cuando examinó adyuvantes)
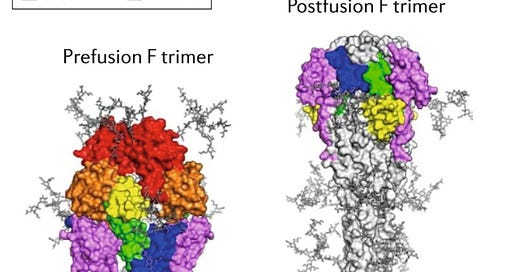
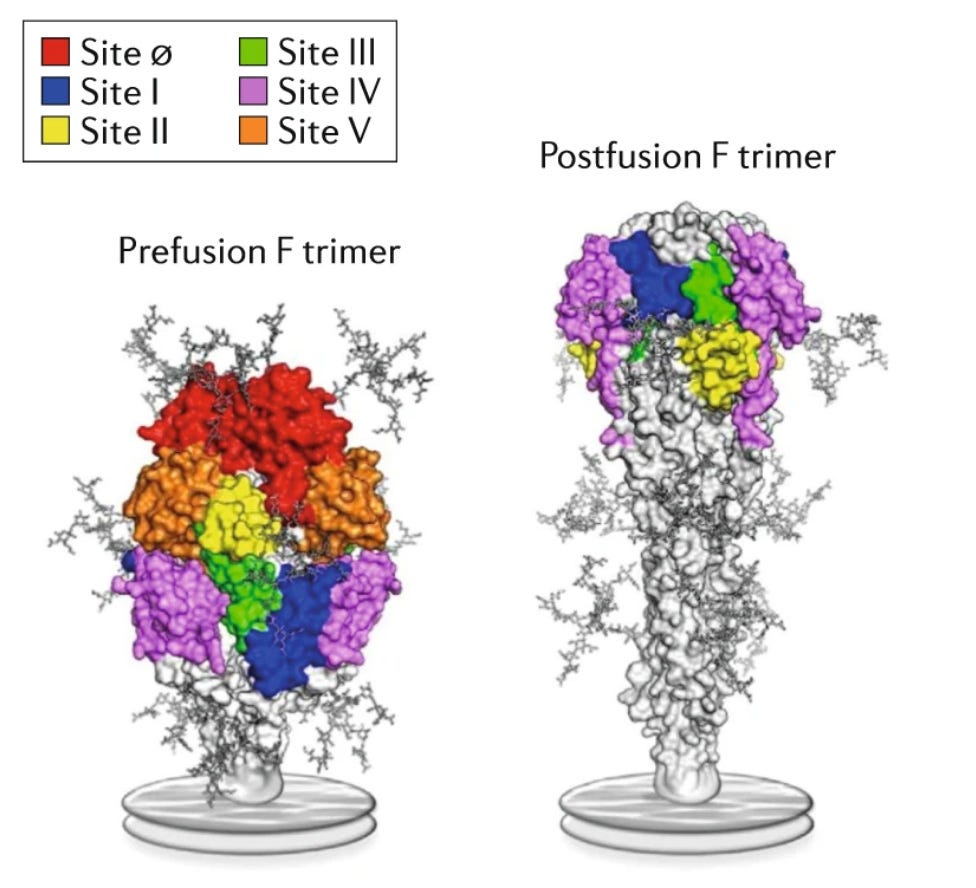
Ambas vacunas se dirigen a la “proteína F”. Es una proteína similar a la proteína espiga del coronavirus–la llave para nuestras células. El problema es que la proteína F de los VRS es extremadamente inestable–cambia entre dos “formas” (prefusion y posfusión, vea la imagen superior). Las vacunas inducen anticuerpos específicamente contra las partes naranjas y rojas, que se encuentran solo en prefusión. Se cree que el fracaso de las primeras vacunas se debió a que no se dirigieron a estas zonas.
Seguridad
Las compañías investigaron los efectos secundarios por sí mismas, administrando las vacunas a la vez que la de la gripe, y después de la de la gripe. Estas dos últimas situaciones son probablemente más cercanas a la realidad en el otoño. No probaron la administración conjunta con la vacuna de COVID-19 (no está claro por qué, pero estos estudios se harán).
Efectos secundarios, como fiebre o dolores corporales, después de la dosis no fueron muy comunes. Un alivio después de las vacunas de COVID-19.
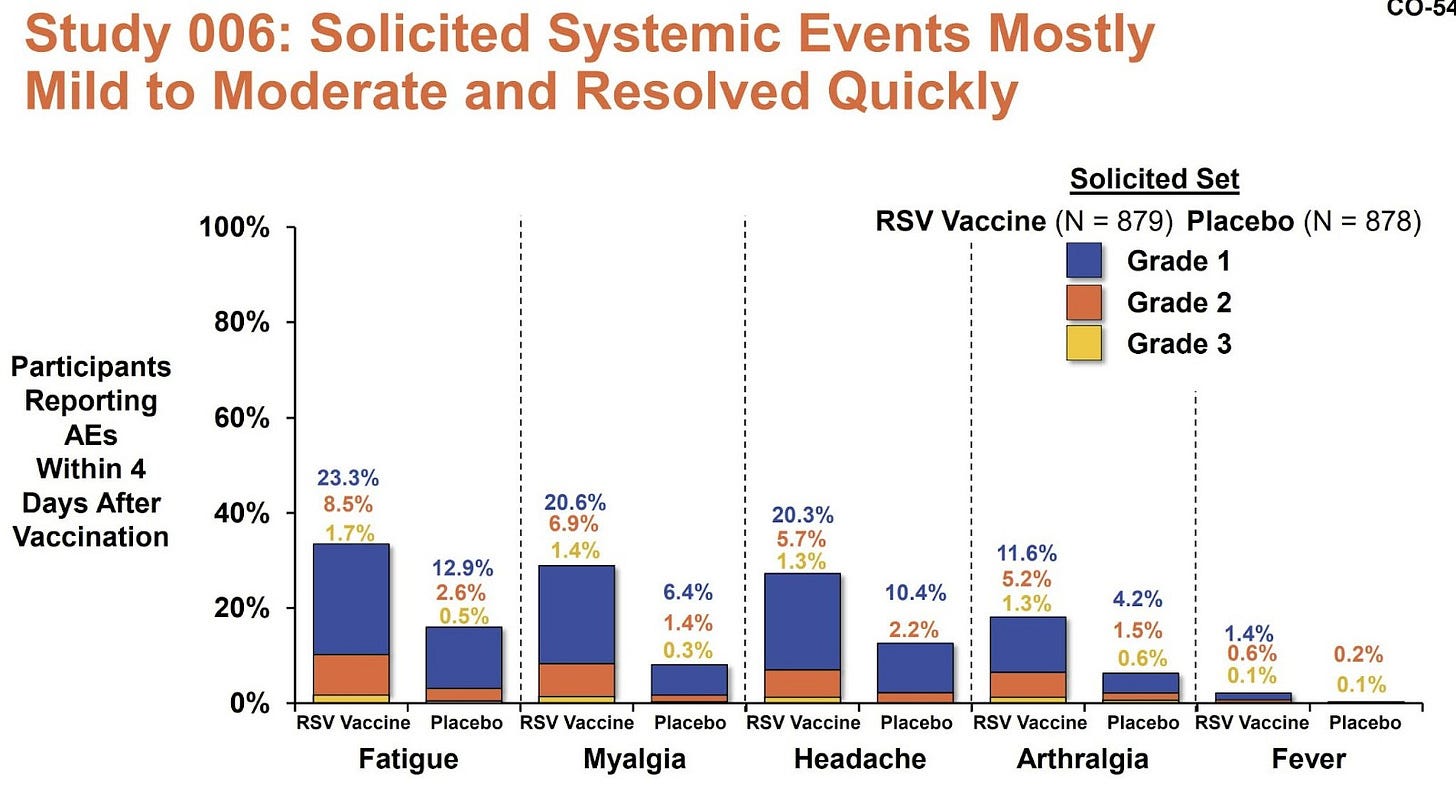
Los efectos secundarios severos fueron raros y similares entre el grupo de vacunados y el grupo placebo. Sin embargo, hay dos señales potencialmente preocupantes:
Encefalomielitis diseminada aguda (ADEM, por sus siglas en inglés)––un trastorno neurológico en el que el cerebro y la médula espinal se inflaman.
GSK: 2 casos en participantes que recibieron la vacuna a la vez entre 890 individuos. Juntando todos sus ensayos, es una tasa de 2 sucesos por 15,000.
Tasa de base: 1-2 casos de ADEM por 250,000 personas al año.
Síndrome de Guillain-Barré (GBS, por sus siglas en inglés)––también un daño en los nervios producido por la inflamación que produce hormigueo y en el peor de los casos, parálisis.
GSK: 1 caso con una incidencia total de aproximadamente 1 por 15.000.
Pfizer: 2 casos con una incidencia de aproximadamente 1 por 9.000.
Tasa de base: 1.5 a 3 por 100.000 personas al año.
Es preocupante que ambas vacunas hayan producido efectos adversos similares y en tasas también similares, que en sentido absoluto, están muy por encima de la tasa de base.
Eficacia
¿Cómo funcionan de bien frente a la enfermedad severa? Se definió como el número de síntomas respiratorios de vías bajas (como sibilancias, necesidad de respirar más rápidamente o necesidad de oxígeno suplementario).
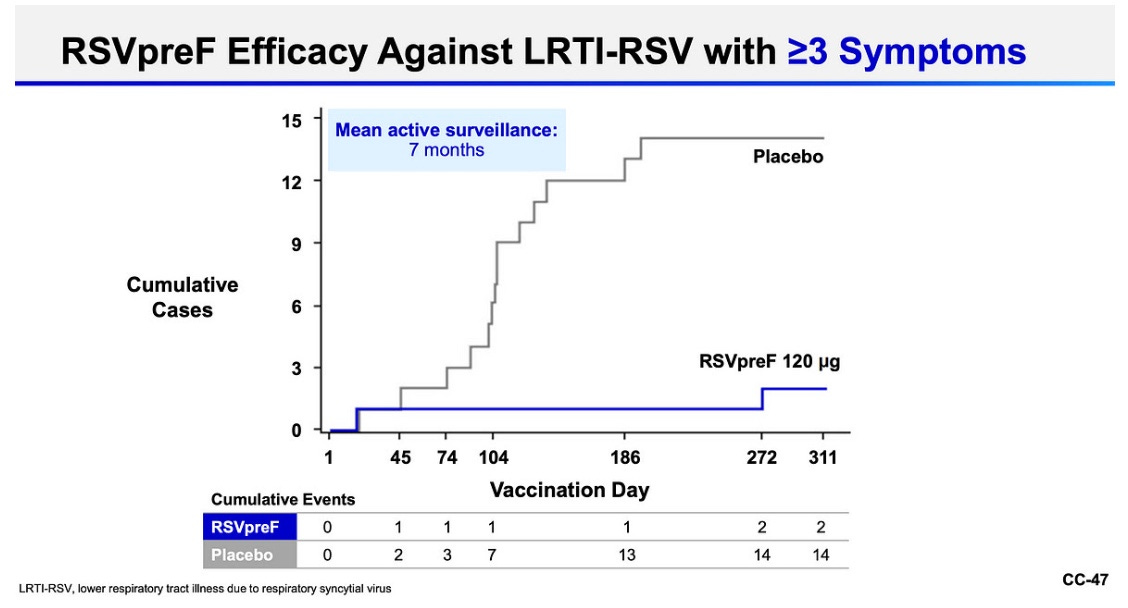
Las vacunas en conjunto fueron muy eficaces:
GSK: 82% de eficacia (7 eventos en el grupo de vacuna y 40 en el grupo placebo)
Pfizer: 86% de eficacia (2 eventos en el grupo de vacuna y 12 en el grupo placebo). También midieron síntomas menos severos, equiparándose con un 66% de eficacia (11 en el grupo de vacuna y 33 en el grupo placebo).
Esta eficacia se mantuvo por grupos de edad, por severidad de los síntomas, por cepa de VRS. No tuvieron muchos participantes con comorbilidades, y la eficacia para ellos se mantuvo más o menos igual, aunque con menor certeza de cómo se traducirá esto en el mundo real.
Además, el número absoluto de eventos que ocurrieron fue muy pequeño (especialmente con la vacuna de Pfizer), lo que significa que hay mayor incertidumbre sobre la eficacia. Sin embargo, un modelo de infección controlada en individuos sanos de 18 a 50 años que recibieron la vacuna de Pfizer mostró excelentes resultados, lo que sugiere que estas medidas (aunque obtenidas de adultos mayores) son probablemente válidas.
Discusión
La principal fuente de duda para este comité está en los efectos adversos, especialmente ADEM y GBS. Sin embargo, dado que el número de casos es tan pequeño, es difícil saber si son hechos casuales o si reflejan un problema real de seguridad. Además, como la incidencia de base es tan baja, sería muy difícil hacer un estudio controlado aleatorio dada la cantidad de personas que habría que alistar para tener casos suficientes.
Uno de los miembros mencionó la preocupación por la comunicación en torno a estas vacunas dado el ambiente de desinformación. El presidente del comité incluso dijo “tenemos que preocuparnos del programa de vacunación y no solo del patógeno”
El comité defendió el lanzamiento de las vacunas con monitorización aumentada para estos dos trastornos para definir cuánto aumento de riesgo hay y entonces reevaluar.
Durabilidad. Se examinó la durabilidad de la vacuna de GSK midiendo los títulos de anticuerpos en el tiempo y por grupo de edad; como era de esperar, disminuyeron con el tiempo aunque se mantuvieron elevados comparados a los niveles prevacuna. Las respuestas de células T mostraron un patrón similar.
Sin embargo, lo que esto implique para la protección frente a infección severa en humanos no se sabe actualmente. Y es de particular importancia con VRS porque sabemos que la inmunidad inducida por la infección es incompleta.
Lamentablemente, los ensayos clínicos fueron muy cortos como para hacer seguimiento de las vacunas entre estaciones. Pero ambas compañías van a recoger más datos para entenderlo mejor.
Algunos miembros del comité de expertos expresaron que dado que el VRS no es actualmente una emergencia de salud pública en este grupo de edad, sería mejor llevar a cabo ensayos clínicos para obtener más datos antes de conceder la licencia.
Voto
Los miembros votaron si la FDA debería seguir adelante con estas solicitudes. La mayoría votaron que sí, pero fue un voto muy ajustado (dadas las fuentes de duda comentadas anteriormente).
¿Y ahora qué?
La pelota está en la cancha de la FDA. Como las compañías han solicitado una licencia, llevará mucho tiempo (meses) hacer todo el papeleo. Entre tanto, iremos teniendo más datos disponibles y los seguiremos de cerca.
En resumidas cuentas
Parece que los adultos mayores tendrán una manera más de protegerse en el otoño de 2023. Tener una primera vacuna frente a VRS es un gran logro para la salud pública. Las primeras vacunas de VRS son un asunto importante, aunque aún tenemos preguntas sobre cuál es su mejor uso. Los datos futuros nos van a ayudar.
Love, YLE y Edward Nirenberg
Su Epidemiólogo Local (YLE) está escrito por la Dra. Katelyn Jetelina, MPH, PhD— doctora en epidemiología y bioestadística, esposa y madre de dos niñas pequeñas. De día, trabaja en un comité de expertos en política sanitaria y es consultora para un número de organizaciones, incluyendo los CDC. Por las noches escribe este boletín informativo. Su objetivo principal es “traducir” la ciencia de salud pública, en constante evolución, para que las personas estén bien preparadas para tomar decisiones basadas en datos científicos. Este boletín informativo es gratis gracias al apoyo generoso de los miembros de la comunidad YLE. Para contribuir a este esfuerzo, por favor suscríbase aquí.
Colaborador invitado Edward Nirenberg