Ya llega la vacuna para los menores de 5...aunque tengo preguntas
Hoy, Pfizer ha anunciado que planea entregar la solicitud de Autorización de Uso de Emergencia (EUA, por sus siglas en inglés) de la vacuna de COVID19 para niños menores de cinco años. A continuación voy a intentar explicarles lo que se sabe (y lo que no) acerca del difícil camino hasta la regulación para nuestros más pequeños.
¿Qué ha ocurrido hasta llegar a este momento?
El proceso completo para lograr una vacuna para los menores de 5 años comenzó en mayo de 2021. Desde entonces, Pfizer ha completado varios pasos necesarios para conseguir que se apruebe la vacuna. Hablé de ello extensivamente en una publicación previa, pero aquí tienen un resumen:
Mayo de 2021: Los ensayos clínicos de Pfizer con niños de 6 meses a 5 años comenzaron.
Esto fue casi un año después de haber comenzado los ensayos clínicos de adultos, lo que es un diseño escalonado típico: se prueba con adultos antes de probar con poblaciones más vulnerables como los niños.
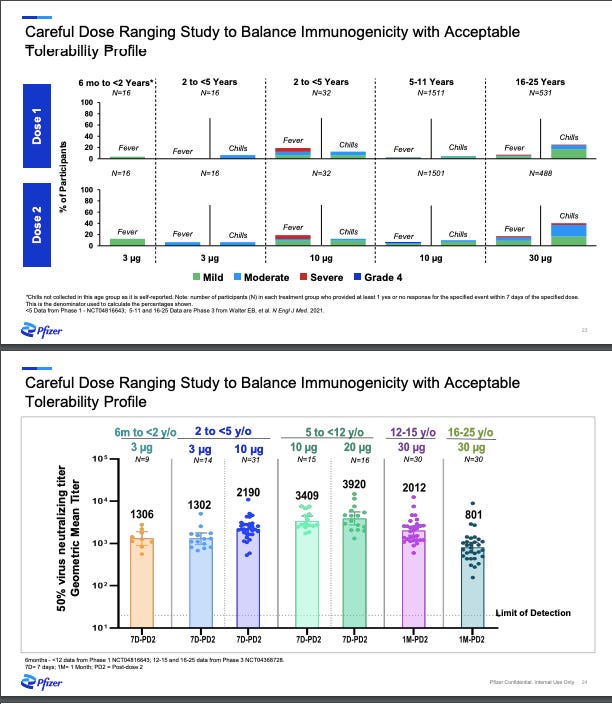
Fase I/IIa: Pfizer comenzó con el primer paso: La Fase I del estudio para “encontrar la dosis” en la que probaron diferentes dosis: 3µ, 10µ, 20µg y 30µg (la dosis de adultos) con una docena de niños sanos. Su objetivo principal era encontrar un “punto óptimo”-la dosis mínima posible que permitiera el menor número de efectos secundarios, pero consiguiendo generar una respuesta inmune. En otras palabras, ¿Cuál es la dosis mínima con el beneficio justo? Las compañías farmacéuticas abordan de diferentes formas la búsqueda de este “punto óptimo” de las vacunas. Por ejemplo, mientras Moderna ha intentado empujar el límite (cúal es la máxima dosis con el menor riesgo), Pfizer ha hecho lo opuesto (cúal es la dosis mínima con el beneficio justo). Como se pueden imaginar cada abordaje tiene sus ventajas e inconvenientes.
No obstante, Pfizer anunció en una reunión con un inversor (mire el gráfico a continuación) que 3µg (la dosis más baja) funcionaba. Decidieron no seguir adelante con los 10µg por la mayor tasa de fiebre entre los de 2 a 5 años.
Fase IIb/III: La siguiente fase de los ensayos clínicos es en la que un grupo más grande- unos dos mil niños- reciben la “dosis óptima” (3µ). Con un mayor número de niños, los científicos confirman la dosis, y además tienen más “poder” para detectar efectos secundarios raros y aumentar la capacidad de generalizar el impacto de la vacuna, al incluir un rango variado de edades, razas/identidades étnicas, niños con enfermedades de base, etc. En este punto, Pfizer también evaluó la eficacia de la vacuna separando niños aleatoriamente en un grupo que recibió vacuna y otro placebo. Esto permitió a los científicos evaluar un resultado predeterminado preliminar llamado “inmunobridging”. No fue una valoración de eficacia porque ya sabíamos que la biotecnología funcionaba por los ensayos en adultos. Pfizer solo necesitaba asegurarse de que una dosis menor funcionaba igual de bien. ¿Puede una dosis menor (3µg) producir la misma respuesta inmune en los menores de cinco años que la dosis completa (30µg) produce entre los de 16 a 25 años?
Diciembre 2021: Pfizer anunció los resultados de la fase II/III del ensayo clínico. Había dos victorias y una gran derrota.
Victorias: la vacuna era segura y no ocurrieron efectos secundarios severos. La dosis de la vacuna funcionó para niños entre 6 meses y 2 años.
Derrota: la dosis de la vacuna no funcionó para el grupo de edad de 2 a 5 años.
¿Qué ha ocurrido hoy?
Pfizer ha anunciado que buscará la Autorización del uso de Emergencia para las dos primeras dosis (3µg) para menores de cinco años. Pfizer no tiene datos de la tercera dosis en este grupo de edad porque esto lleva tiempo (y continúan los ensayos clínicos para eventualmente tenerlos). Si no hay datos nuevos desde el último comunicado de prensa(diciembre 2021), entonces ¿Qué ha cambiado? No lo sé. Pero si leemos entre líneas, podemos asumir que tiene que ver con Ómicron:
La fase IIb/III del ensayo clínico utilizó el mismo resultado que para los de 5-11 años: medir los anticuerpos neutralizantes. Los anticuerpos neutralizantes son nuestra primera línea de defensa y ayudan a prevenir la infección completamente–actúan rápidamente por lo que el virus no entra en nuestras células y por tanto no se replica, así que no tenemos síntomas, no nos hacemos contagiosos y no transmitimos el virus.
Antes de Ómicron, los anticuerpos neutralizantes funcionaban realmente bien. Con Ómicron sin embargo, nuestra primera línea de defensa queda mermada sin la dosis de refuerzo. Afortunadamente, nuestra segunda línea de defensa (células-T) todavía funciona. En gran medida, esto es lo que permite a personas parcialmente vacunadas mantenerse fuera de los hospitales. Así que esto requiere una pregunta: ¿Todavía son los anticuerpos neutralizantes una medida clara para indicar que la vacuna es útil? O ¿Deberíamos evaluar la activación de células-T o más ampliamente, la eficacia frente a hospitalización y muerte?
Probablemente ha habido debates a puerta cerrada en la FDA. Todo mientras Ómicron se infiltraba en reductos no vacunados, incluyendo los niños, como nunca lo habíamos visto antes. Además el virus sigue mutando. En conjunto, este panorama cambiante está probablemente presionando a la FDA a reconsiderar los objetivos a mitad de partida.
¿Qué pasa ahora?
La solicitud para EUA de Pfizer necesita entregarse oficialmente a la FDA (la nota de prensa dice que Pfizer lo está haciendo). La FDA revisará los datos, lo que lleva de 4 a 6 semanas.
Lo siguiente es que la FDA pueda convocar al VRBPAC. VRBPAC es un comité científico externo que revisaría los datos para dar su opinión acerca de la seguridad y efectividad de la vacuna en menores de 5 años. Este paso no se llevó a cabo para la vacuna de Pfizer en adolescentes; VRBPAC no tiene que convocarse para una corrección de EUA. Si se convoca, habría un debate interesante, porque este comité ha dejado claro en reuniones anteriores que requieren datos rigurosos para tomar decisiones. Solo dos miembros con derecho a voto han reconocido verbalmente que algunas veces han tomado decisiones con datos limitados. VRBPAC podría decidir (por voto mayoritario) que no tenemos suficiente justificación para autorizar la vacuna en menores de cinco años. La FDA toma la decisión final, pero casi nunca van en contra del voto de VRBPAC. Hay mucho poder en juego aquí.
CDC Review: Si la FDA no convoca al VRBPAC o el VRBPAC vota que la vacuna es segura y efectiva, entonces esto va al ACIP (un comité científico externo de la CDC). ACIP valora la seguridad y efectividad también. Pero su papel principal es la regulación: quién recibe la vacuna y cómo, consideraciones de equidad global, etc. Por ejemplo, ACIP podría considerar que la vacuna solo debería estar disponible para los menores de dos años. O podrían puntualizar en un uso fuera de lo indicado. ACIP es increíble en llevar a cabo rigurosos análisis de beneficio-riesgo, incluso con datos limitados. Así que vamos a sumergirnos bien en los riesgos y beneficios de su propuesta de regulación. ACIP entonces votará si recomienda divulgar la vacuna en los Estados Unidos. Por último, el director de la CDC hace la recomendación final.
Muchas preguntas
Como pueden ver, hay datos muy limitados y muy poca transparencia por ahora. Así que, de aquí en adelante necesitamos respuestas a las siguientes preguntas clave:
¿Cuáles eran los datos originales de la fase III en menores de 5 años? ¿Qué diferencia había en respuesta de anticuerpos neutralizantes para el grupo de 2-5 años? Si había mucha diferencia, ¿Qué confianza tenemos en empezar a vacunar y esperar a que la tercera dosis funcione?
¿Cuál es la nueva medida y por qué se ha elegido? ¿Son las células-T, las hospitalizaciones o algo más?. Si son las hospitalizaciones, y dado que éstas son más raras en niños¿Tiene Pfizer una muestra suficientemente grande de niños para medir la efectividad con confianza?
¿Cuál es el perfil de seguridad de la dosis propuesta para menores de cinco años?
¿Cuál es el plan si la tercera dosis funciona o no funciona? ¿Está Pfizer evaluando simultáneamente otras dosis?
En resumidas cuentas: Espero no haber creado más confusión, pero…es complicado. Como madre de dos niñas menores de cinco años, no podría estar más ilusionada con que la vacuna avance. Como epidemióloga, tengo muchas preguntas. Tendremos respuestas en las próximas semanas mientras todo evoluciona. Seguiré informando, como siempre, con los apuntes ¡Ánimo!
Love, YLE